Multi-målrettet kreftbehandling
Andre valgmuligheter
Andre valgmuligheter som har vist seg virksomme ved kreft
- Bee-propolis/cape [1]
- Cantron [1, 3]
- Germanium 132 [1]
- Hoxsey formula (G)
- Laetrile [1]
- Logwood ekstrakt i DMSO
- Neem
- Oleander [1, 2, 3>, 4, 5]
- Olivenblad tea [1] / ekstrakt [1]
- PawPaw [1, 2, 3, 4]
- Poke root tea [1] (G)
- Rodent tuber/Typhonium flagelliforme
- Selen (Sodium Selenite) [1, 2] (N)
Fremme oksidativt stress
Fremme oksidativt stress
Her utnytter man kreftcellenes tilbøylighet til å akkumulere store mengder jern, ved å ta kosttilskuddet artemisinin oksidere man jernet, noe som igjen fører til at kreftcellene dør av de frie radikalene som oppstår i oksidasjonsprosessen.
Dette er en hurtigvirkende, effektiv og skånsom tilnærming som i liten grad vil påvirke de normale cellene i kroppen. Artemisinin sine virkningsmekanisme vil ofte ikke favne vidt nok til at den greier å ødelegge alle kreftcellene, men det er en tilnærming som ofte kan stoppe hurtigvoksende kreftceller. Dette er en pro-oksidant strategi der man ikke bør konsumere antioksidanter. For å effektivisere tilnærmingen benyttes injeksjoner med ferric gluconate kompleks (jerntilskudd).
Primært:
Mulige synergister
- Auranofin
- Badstu (hypertermi)
- Butyrate [1]
- CAPE (caffeic acid phenethyl ester)
- Dipyridamole [1]
- Disulfiram
- Ferric gluconate kompleks [1]
- Sanguinarine
- Sulfasalazine
- Sølvvann
PARP Hemmere
PARP-hemmere
PARP kalles det enzymet som blant annet regulere de funksjonene som reparere skader som påføres kreftcellers DNA. I denne tilnærmingen søker man å hemme dette enzymet. Ved å hemme PARP sin funksjon vil DNA`et forbli ødelagt og kreftcellens celledelingssyklus blir forstyrret, slik at kreftcellene til slutt dør uten evne til videre celledeling. PARP-hemmere ser også ut til å kunne hemme androgen reseptor aktivitet og kan således være et godt alternativ ved hormondrevet kreft.
PARP aktivitet er ikke kritisk for normale celler, men en overaktivisering av PARP er derimot en fundamental mekanisme i kreftcellers evne til å formere og mutere seg videre. En kan derfor trygt senke nivået av PARP uten at en påfører kroppen varig skade.
PARP-1 er kjent for å være spesielt aktiv hos kreftformene bryst-, eggstokk- og kolorektal kreft. Denne unormale ekspresjonen av proteinet øker med stadium av sykdommen – høyere uttrykk er assosiert med en dårlig prognose. Derfor er PARP-1 et godt mål for kreftbehandling og mange eksperimentelle PARP-1 hemmere har vist lovende resultater i kliniske studier.
PARP-hemmere benyttes ofte sammen med kjemoterapistrategier og ved strålebehandling for å hemme kreftcellenes evne til å reparere seg etter skade.
Under er noen milde PARP-hemmere listet opp, men disse er saktevirkende, så en må ha en løpende vurdering av nytteverdien ved bruk av disse substansene.
Primært
- Olaparib
- Niacinamide
- Theobromine
Sekundært
- Ashwagandha (MCMBP hemmer)
- Curcumin
- NAC
- Resveratrol
Synergister
- HDAC – hemmere
- Hypertermi
- PARP-hemmere kan med fordel benyttes sammen med cellegifter
- Pau d`aco i tilfeller av bryst-, blære-, ikke-småcellet lunge-, bukspyttkjertel-, tykktarm- og prostatakreft
Niacinamide, curcumin og NAC vil fremprovosere resistens mot arsenikk, som kan være et effektivt hjelpemiddel ved enkelte former for kreft. PARP-hemmere skal heller ikke benyttes i forbindelse med røntgen.
Tilbake til artikkel: Multi-målrettet kreftbehandling
Kilder
- High speed of fork progression induces DNA replication stress and genomic instability. Nature 559, 279–284 (2018).
tNOX hemmere
tNOX hemmere
NOX er et protein som er involvert i cellevekst. Normale celler utrykker NOX enzymet bare når de deler seg i respons fra veksthormonsignaler. Kreftceller uttrykker NOX aktivitet til enhver tid. Denne overaktiviteten er kjent som tNOX – for tumorbundet NOX.
tNOX tillater cellene å ekspandere, noe som er nødvendig for cellulær vekst og utvikling. Hemmes tNOX vil kreftcellene ikke kunne ekspandere etter celledelingen, og dø i løpet av dager. tNOX sitter eksponert på cellemembranen, og kan hemmes ved hjelp av capsaicin og grønn te ekstrakt.
Hemming av tNOX aktivitet ved hjelp av capsaicin viser seg å korrelere med en reduksjon i veksten av kreftceller, og legemidler som hemmer tNOX aktiviteten viser seg også å blokkere cellevekst i cellekulturer. Dette viser oss at det er en nær sammenheng mellom tNOX aktivitet og cellevekst, og muliggjør en målrettet bivirkningsfri metode for å ødelegge kreftceller.
Sammen med DIM (Diindolylmethane) og grønnsaker fra kålslekten (spesielt brokkoli og brokkolispirer) vil dette kunne danne en effektiv strategi.
HDAC hemmere
HDAC hemmere
HDAC (histon deacetylase) hemmere har vokst frem som et lovende mål for krefthemmende medikamenter. De virker ved å stoppe videre vekst, eller ved å direkte ødelegge kreftcellene. Over 80 kliniske studier er under vei, og en tester i dag mer enn 11 forskjellige HDAC hemmende stoffer mot hematologisk- og solide ondartheter.
Under utvikligen og progresjon av kreft skjer epigenetiske endringer som for eksempel avvikende histon deacetylase aktivitet, noe som fører til avvikende genuttrykk og manglende evne til å kontrollere biologiske prosesser som cellevekst, -modning og -død. Ondartede forandringer i genuttrykk har vist seg å kunne reverseres av histon deacetylase hemmere, og det i så stor klinisk betydning at de kan benyttes som en mulig hovedstrategi sammen med differensieringsinduserende terapi ved saktevoksende lavgradig kreft.
HDAC proteiner er blitt observert å ha et høyere uttrykk i visse krefttyper, og siden HDAC spiller en viktig rolle i regulering av gentranskripsjon, og er involvert i viktige biologiske prosesser som celleproliferasjon, differensiering og overlevelse, så assosieres denne økningen i aktivitetsnivået til HDAC med tumorutvikling. Prosessen er ennå ikke fullt ut forstått, men en ser at HDAC hemmere enten tenderer til å stoppe kreftcellene i G1 eller G2-fasen i cellesyklusen, indusere differensiering eller fremme apoptose i et bredt spekter av kreftcellelinjer.
Planteekstraktet parthenolide har vist seg å være avgjørende for at denne tilnærmingen skal kunne reversere og kontrollere kreft. Parthenolid sin evne som HDAC hemmer har gjort parthenolid spesielt interessant i behandling av kreft. Tilskudd av parthenolid fører nemlig til en signifikant senkning av histon deacetylase 1, som er en primær epigenetisk hemmer av vekstkontroll-gener hos kreftceller. Parthenolid benyttes alltid i kombinasjon med epilepsimedisinen Valproic acid, som også har vist seg som en effektiv hemmer av histon deacetylase.
Primært
- Trichostatin A/Hydroxylamine (L)
- Valproic acid/magnesium valproate (L)
- Vorinostat (L)
- Parthenolide i syklodekstrin
- Phenylacetate
- SAHA
Sekundært
- Sodium Butyrate
- Sodium phenylbutyrate
- Brokkoliekstrakt
Et problem med bruk av HDAC hemmere i behandling av kreft er at de ikke bare induserer apoptose, men også induserer aktivering av NF-kB, en transkripsjonsfaktor som spiller en aktiv rolle i prosesser som inflammasjon, metastasering, apoptose og stimulering av proliferasjon. Parthenolid har vist seg å virke uavhengig av dette, men siden parthenolid som regel benyttes i en kombinasjonsprotokoll sammen med andre HDAC hemmere kan en gjøre lurt i å supplere med Sulindak og curcumin for å hemme NF-kB aktivering.
Synergister
- Mitomycin C (L) (ødelegger DNA)
- Pau d`arco (hemmer G2-fasen i cellesyklusen)
Kilder
Oral sodium phenylbutyrate in patients with recurrent malignant gliomas: A dose escalation and pharmacologic study1, Neuro-oncol. 2005 Apr; 7(2): 177–182.
Hemme MMP enzymer
Hemme MMP enzymer
Ekstracellulære matriks (ECM) betegner substansen som finnes mellom cellene i kroppen, og er den første barrieren mot tumorinvajson. Denne strukturen er ikke statisk, men gjennomgår konstant remodulering i respons av cellulære signaler fra omkringliggende vev. En rekke makromolekyler inngår som byggestener i ECM, og variasjonen i måten molekylene er organisert og den relative mengden av de ulike komponentene gir opphav til et spekter av ulike former, der hver enkelt form er tilpasset til funksjonen i det aktuelle vevet.
Matriks metalloproteinaser (MMP) er en gruppe endogene proteinasar involvert i en rekke fysiologiske og patologiske prosesser. Enzymene medvirker under modulering av vev gjennom fosterutvikling, sårhelning samt ved aktivering av en rekke immunkomponenter. Nesten alle krefttyper viser å ha et økt uttrykk og aktivering av denne enzymgruppen. Grad av remodulering varierer fra å være lav i vev med sen turnover til svært høy ved tilfeller av inflammasjon og aggresiv kreft. En ser at høye nivåer av disse enzymene samsvarer med økt invasjon, angiogenese og metastasering.
Matriks metalloproteinaser (MMP) er en familie på nesten 30 enzymer som er nært involvert i remodelering av vev. Sykdomsprosesser assosiert med matriks metalloproteinaser er generelt relatert til en ubalanse mellom inhibering og aktivering av matriks metalloproteinaser som så resulterer i en overdreven forringelse av ECM. MMP enzymene er i stand til å bryte ned omtrent alle komponentene som inngår i den ekstracellulære matriksen. Og en av hovedårsakene til spredning av kreftceller er utskillelse av matriks metalloproteinaser (MMP) enzymer i fra det stromale vevet rundt tumoren, og i noe mindre grad fra selve kreftcellene. MMP enzymer er regulert ved transkripsjonsnivået etter stimulering av ulike hormon, cytokin og vekstfaktorer fra stromaceller, kreftceller og inflammasjonceller.
Denne tilnærmingen tar sikte på å blokkere eller gjøre det vanskeligere for de MMP proteolytiske enzymene å bryte ned det ekstracellulære matriks rundt kreftcellene. MMP hemmere benyttes som primærbehandling ved lavgradig kreft og sovende lesjoner, og ofte sammen med en anti-angiogenese strategi.
For å blokkere MMP enzymer og hindre kreftceller i å bryte ned det ekstracellulære matriks som omgir kreftcellene og blodårene rundt kan man benytte tilskudd som:
Primært:
- Curcumin
- Genistein (N)
- Grønn tea (EGCG) (N)
- Lav dose doxycycline (L)
Sekundært:
- Anthocyanidin (blåbær, kirsebær og røde rips)
- Grapefrukt ekstrakt (N)
- Magnesium
- Proanthocyanidin (aronia, eple, kanel, etc)
- Pycnogenol
- Quercetin
Det vil og kunne være gunstig å senke nivået av zinc i kroppen, da matriks metalloproteinaser (MMP) enzymer er avhengige av zinc for å kunne fungere.
Differensieringsinduserende terapi
Differensieringsinduserende terapi
I alle normale vev må cellene dirigeres mot enten celledeling, differensiering mot spesialiserte aktiviteter eller destruksjon. Ved å fremprovosere differensiering søker man å stimulere de ondartete celler til å gjenoppta sine opprinnelige funksjoner slik at de kan fortsette sitt naturlige livsløp, og dermed dø en naturlig død.
Grad av celledifferensiering er mål på modenheten til en celle. Modne celler er fullt differensierte og likner sitt opphav i form og funksjon, og de sprer seg langsomt, om enn i det hele tatt. Umodne celler er dårlig differensierte og vil ha lite til felles med sitt opphav, og de har evne til å spre seg hurtig. Etter hvert som kreftutviklingen skrider frem går kreftcellen fra å være celler som likner sitt opphav i form og funksjon til å bli kreftceller som i liten grad er differensierte, og som er umodne primitive celler som lett kan spre seg.
I hvilken grad en celle differensieres reguleres av genene som uttrykkes i cellen. Ved å manipulere disse så kan man endre grad av differensiering. En rekke naturlige forbindelser er kjent for å kunne indusere differensiering i kreftceller. Slik kan de redusere kreftcellenes spredningsrate og stimulere ondartete celler til å gjenoppta noen av sine opprinnelige funksjoner og fortsette sitt naturlige livsløp, og dermed dø en naturlig død.
Dette er en strategi som benyttes som hovedstrategi ved lavgradig kreft der kreftcellene grunnet sin nærmest sovende tilstand vil være vanskelige å nå med annen behandling. I disse tilfellene vil differensieringsterapi, EMT hemmer og immunterapi kunne være en kurativ tilnærming. Dette er ikke en terapiform der det kan forventes raske resultater, da det typisk tar seks måneder før en ser merkbare resultater – ved langtkommende høygradige kreftceller vil denne tilnærmingen kun bremse videre utvikling. Differensieringsterapi kan med fordel benyttes etter bruk av kjemoterapi – som typisk retter seg mot de høygradige hurtigvoksende kreftcellene.
Primært:
- Benzaldehyde i syklodekstrin
- Vitamin D
Sekundært:
Synergister vil være PPAR antagonister. De beste PPAR antagonistene vi har for øyeblikket er diabetesmedisiner (glitazoner) – inkluderer en glitazoner i tilnærmingen vil dette kreve en jevnlig kontroll av blodsukkernivået. Delta-tocotrienol og inflammasjonsdempende tiltak vil forøvrig kunne styrke denne tilnærmingen.
EMT hemmere
EMT hemmere
Tumorer kan ikke kun forstås eller defineres ut i fra spesifikke trekk ved kreftcellene, men må sees i sammenheng med miljøet rundt selve kreftcellene.
Rundt tumorer dannes det et bindevev som kalles stroma, og kreftcellene vokser i symbiose med dette vevet. Innenfor moderne kreftbehandling benytter en ikke bare målrettede behandlinger mot selve kreftcellene, men en forsøker også å forstyrre kreftcellenes samhandling med dette vevet, en samhandling som har vist seg avgjørende for kreftcellenes videre vekst og metastasering.
EMT (Epitelial-til-mesenkymale transisjon) er en viktig prosess i normalutvikling av blant annet organer, vev, sårhelning og embryo. Tumorprogresjon ved tilfeller av karsinom skjer også gjennom fremvekst av EMT i bindevevet rundt tumoren – EMT innebærer molekylære endringer som redusert uttrykk av epiteliale markører til fordel for et sett av mesenkymale karakteristika. Kreftcellene går da gjennom en utvikling fra å være stedbundne til å erverve egenskaper som gjør at de evner å løsne seg fra en primærtumor for så til slutt å kunne spre seg gjennom blodet.
Epitelceller er normalt differensierte celler som danner overflatevev som dekker en rekke kjertler og de fleste overflater i og på kroppen. De er ikke-bevegelige celler som er organisert tett sammen for å danne et kontinuerlig lag over en basalmembran, og de henger sammen ved hjelp av ulike festemolekyler (adhesjonsmolekyler). Disse molekylene binder cellene sammen og forankrer dem til den underliggende basalmembranen. Ved en overgang til mesenkymale karakteristika svekkes koblingen mellom de epiteliale cellene, og cellene får da et mer migrerende karakteristika med molekylære karakteristika lignende kreft-stamceller – EMT markører er slik korrelert med en dårlig prognose.
Den mest fremtredende endringen er karsinome cellers tap av E-cadherin. E-cadherin er et viktig celle-til-celle adhesjonsmolekyl som ser til at cellene i vevet er bundet sammen. Økt ekspresjon av E-cadherin er etablert som en antagonist av invasivitet og metastasering, mens en reduksjonen av dette molekylet i vevet er kjent for å fremme disse karakteristika – E-cadherin hindre eller vanskeliggjør prosessen kreftcellene må gå gjennom for å infiltrere omliggende vev og danne metastaser.
Evnen til å infiltrere omkringliggende vev, migrere og danne metastaser i andre deler av kroppen er en særdels lite ønskelig utvikling, og en søker derfor selvfølgelig å hemme denne utviklingen om mulig. Celler som gjennomgår EMT kan enten migrere ut fra sitt epiteliale lag til andre steder i kroppen å forbli mesenkymale, eller redifferensiere tilbake til epitelceller.
Heldigvis er dette en prosess som kan påvirkes ved hjelp av terapeutisk intervensjon:
- Pyrvinium hemmer både Wnt og autofagresponsen, som fremmer spredning (EMT) og som hjelper kreftceller å overleve stress.
- Grønn tea ekstrakt (EGCG) har i studier vist seg å kunne være et veldig godt hjelpemiddel for å øke antallet av celle-til-celle adhesjonsmolekylet E-cadherin i vevet, og kan slik hemme utviklingen av invasive og metastatiske karakteristika hos kreftcellene.
- Den indiske urten ashwagandha (inneholder withaferin A) ser ut som en effektiv hemmer av vimentin (et hovedkomponent i mesenkymale celler), og vil slik kunne evne å hemme kreftcellenes overgang til mesenkymale karakteristika.
- Vekstregulatoren transformerende vekstfaktor β (TGF-β), en viktig regulator av EMT, har vist seg å kunne kunne hemmes av Quercetin og berberine.
- Luteolin, en ikke-giftig flavonoid, har vist seg å kunne nedregulerer de mesenkymale biomarkørene N-cadherin, vimentin and Snail, og hemme uttrykket av β-catenin – et av hovedkomponentene i Wnt signalveien som aktiverer EMT transisjon.
- mTOR hemmere (koffein, resveratrol, curcumin og quercetin) og spesielt MSM (Methylsulfonylmethane) har også vist seg som mulige hemmere av EMT.
Dette er en tilnærming som er tenkt å hemme videre vekst og metastaser, og den benyttes ofte for å hemme tilbakefall etter innledende behandling, og da gjerne sammen med immunterapi som for eksempel LDN.
Kilder
- https://www.cancertreatmentsresearch.com/pyrvinium-pamoate/
- Epithelial-to-Mesenchymal Plasticity Harnesses Endocytic Circuitries. Front Oncol. 2015 Feb 26;5:45.
- Cancer Stem Cells and Epithelial-to-Mesenchymal Transition (EMT)-Phenotypic Cells: Are They Cousins or Twins?Cancers 2011, 3, 716-729; doi:10.3390/cancers30100716. Recent studies have demonstrated that EMT plays a critical role not only in tumor metastasis but also in tumor recurrence and that it is tightly linked with the biology of cancer stem-like cells or cancer-initiating cells. Here we will succinctly summarize the state-of-our-knowledge regarding the molecular similarities between cancer stem-like cells or CSCs and EMT-phenotypic cells that are associated with tumor aggressiveness focusing on solid tumors.
- Berberine Inhibits the Metastatic Ability of Prostate Cancer Cells by Suppressing Epithelial-to-Mesenchymal Transition (EMT)-Associated Genes with Predictive and Prognostic Relevance. Int J Med Sci. 2015; 12(1): 63–71.
- Berberine induces neuronal differentiation through inhibition of cancer stemness and epithelial-mesenchymal transition in neuroblastoma cells. Phytomedicine. 2016 Jun 15;23(7):736-44
- A Natural Isoquinoline Alkaloid With Antitumor Activity: Studies of the Biological Activities of Berberine. Front Pharmacol. 2019; 10: 9
Cellesyklus-hemmere
Cellesyklus-hemmere
Cellesyklusen er en kontrollert rekke av irreversible hendelser som normalt fører til celledeling. Mange komplekse signaler samhandle for å bestemme om cellen skal forholde seg passiv, dele seg, skille seg eller gjennomgå programmert celledød (apoptose).
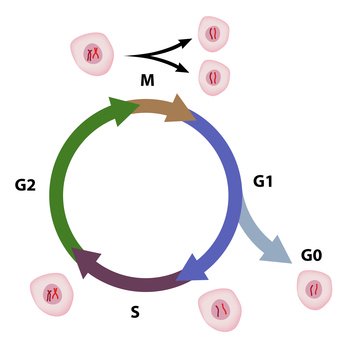 I normale celler er balansen mellom vekstfremmende og veksthemmende signaler nøye kontrollert slik at celledeling kun skjer når det er nødvendig, som ved sårheling og normal fornyelse av vev. En normal celle blir ondartet når cellulær proliferasjon ikke lenger er under normal vekstkontroll – cellen vokser og deler seg da ukontrollert, og kan i noen tilfeller spre seg til andre deler av kroppen.
I normale celler er balansen mellom vekstfremmende og veksthemmende signaler nøye kontrollert slik at celledeling kun skjer når det er nødvendig, som ved sårheling og normal fornyelse av vev. En normal celle blir ondartet når cellulær proliferasjon ikke lenger er under normal vekstkontroll – cellen vokser og deler seg da ukontrollert, og kan i noen tilfeller spre seg til andre deler av kroppen.
Den eneste måten vekst og proliferasjon av kreft kan foregå, er at eksisterende kreftceller deler seg – en målrettet hemming av de ulike delene av cellesyklusen er derfor en meget attraktiv strategi som vil fungere mot alle kreftsykdommer.
Cellesyklusen deles inn i ulike hovedfaser: G1, S, G2 og M.
Økt innsikt i cellesyklusens ulike mekanismer ved tilfeller av kreft har gitt oss kunnskap om hvilken fytokjemikalier som enten kan modulere signalveier som kan regulere eller endre cellesyklus-regulatoriske-molekyler i den hensikt å stoppe en eller flere faser i celledelingssyklusen hos kreftceller. Langvarige avbrudd i cellesyklusen resulterer nemlig i celledød via programmert celledød (apoptose). Lykkes man med å hemme cellesyklusen i tilstrekkelig grad, begår med andre ord kreftcellen selvmord.
Det er i denne tilnærmingen viktig å benytte ulike medisiner og kosttilskudd som har vist seg virksomme mot ulike deler av kreftcellers cellesyklus, dette for å kunne fange opp kreftceller som er i forskjellige deler av cellesyklusen. Men det å hemme celledelingen ved å hemme mikrotubuli-dynamikken har vist seg som en av de mest effektive målene vi har for å reverser kreftutviklingen, og bør prioriteres av de fleste.
Primært
- Albendazole (G2/M) (L)
- Fenbendazole (G2/M) (hemmer mikrotubuli-dynamikken) (L)
- Griseofulvin (G2/M) (hemmer mikrotubuli-dynamikken) (L)
- Mebendazole (G2/M) (hemmer mikrotubuli-dynamikken) (L)
- Pau d`arco (G2/M)
- Resveratrol (G1)
- Rodent tuber (G1)
- Sanguinarine (G1)
- Vitamin K2 og K3 (G2/M)
Sekundært
- Capsaicin
- Cape (caffeic acid phenethyl ester) (G2/M)
- Coriolsus Versicolor (G1/S)
- Curcumin
- Evodiamine (G2/M)
- Sulforaphane
- Matrine, Sophora flavescens (G0/G1)
- Quercetin
Mulige synergister
- Cimetidine
Kilder
- Unexpected antitumorigenic effect of fenbendazole when combined with supplementary vitamins. J Am Assoc Lab Anim Sci. 2008 Nov;47(6):37-40.
- Repurposing Drugs in Oncology (ReDO)—mebendazole as an anti-cancer agent. Ecancermedicalscience. 2014; 8: 443.
- https://www.cancertreatmentsresearch.com/fenbendazole
- https://www.mycancerstory.rocks
- Phase I Clinical Trial to Determine Maximum Tolerated Dose of Oral Albendazole in Patients With Advanced Cancer. Cancer Chemother Pharmacol, 65 (3), 597-605 Feb 2010
- Pilot Study of Albendazole in Patients with Advanced Malignancy. Oncology 2001;61:42–46
- Modulations of Bovine Hepatic Microsomal Metabolism of Benzimidazoles by Secondary Plant Metabolites. J Vet Pharmacol Ther, 42 (2), 222-229 Mar 2019
Anti-angiogenese som kreftbehandling
Anti-angiogenese som kreftbehandling
Angiogenese, eller nydannelse av blodårer, er involvert i vitale prosesser i kroppen, som for eksempel under normal vekst og sårtilhelning. Nydannelsen av blodårer er og helt nødvendig for kreftceller, da kreftceller i liten grad kan vokse uten tilførsel av næringstoffer som glukose og oksygen som blodtilførselen gir dem.
De er og helt avhengig av å kvitte seg med metabolsk avfall og karbondioksid for å kunne utvikle og spre seg. Kreftcellene skiller derfor ut vekstfaktorer som skal stimulere til nydannelse av blodårer. Dette fører etter hvert til en ubalanse mellom vekststimulerende og veksthemmende substanser i vevet, og når kreftcellene blir store nok, og kroppen ikke lenger er i stand til å kontrollere angiogenesen, så gir dette tumoren fri tilgang på næringsstoffer, og slik fritt spillerom for videre vekst, invasjon av omkringliggende vev og metastasering til andre organer.
Angiogenesen er indusert selv i pre-ondartede faser av kreftutviklingen, og forandrer altså en samling av ufarlige abnormale celler til  en masse som kan spre seg til andre organer. Ved å hemme denne prosessen kan man hemme vekst eller holde tumorene i sjakk, men tilnærmingen kan også benyttes for å krympe tumorene. Men er man for aggressiv med denne tilnærmingen i behandling av store tumorer kan man fremprovosere nekrose, og slik fremprovosere metastaser. Tilnærmingen benyttes derfor helst ikke som hovedtilnærming med full aggressivitet (typisk full dose Avastin med synergister) ved store tumorer.
en masse som kan spre seg til andre organer. Ved å hemme denne prosessen kan man hemme vekst eller holde tumorene i sjakk, men tilnærmingen kan også benyttes for å krympe tumorene. Men er man for aggressiv med denne tilnærmingen i behandling av store tumorer kan man fremprovosere nekrose, og slik fremprovosere metastaser. Tilnærmingen benyttes derfor helst ikke som hovedtilnærming med full aggressivitet (typisk full dose Avastin med synergister) ved store tumorer.
Det er tre store synteseveier som må hemmes/stenges, så en kan trolig trygt benytte seg av et fåtall naturlige angiogenese hemmere uten at dette vil stimulere til nekrose hos store tumorer. Anti-angiogenese er spesielt en god hovedstrategi i de tilfeller der man søker å hemme tilbakefall fra annen behandling, og i de tilfeller der det ikke er tumormarkører i blodet.
Strategi for å hemme angiogenesen
Primært:
- Angiostop
- Bindweed
- Cyclophosphamide (lav dose metronomisk administrasjon)
- Fenofibrate
- Vitamin-E (Delta-tocotrienol)
- Tetrathiomolybdate (L)
- Thalidomid
- Celekoksib
Sekundært:
- Agaricus blazei Murrill
- Albendazole
- EGCG
- Genistein
- Haibrusk (krever høye doseringer)
- Itraconazole
- Quercetin [1]
- Theobromine
Kopper deplesjon
- http://www.george-eby-research.com/html/anti_ang.html#app6
- Sølvvann
- Molybdenum
Synergister
En anti-angiogenese tilnærming kan med fordel benyttes sammen med en MMPI strategi, tiltak for å hemme kronisk inflammasjon og med preparater som stopper mikrotubuli-dynamikken, som for eksempel 2-Methoxyestradiol (L), Mebendazole (L) og sulforaphane (brokkoliekstrakt). Det kan i denne sammenheng også med fordel suppleres med immunterapier som retter seg mot å hjelpe immunforsvaret til å gjenkjenne- og ødelegge kreftcellene.
Kilder
- Memorial Sloan Kettering Cancer Center, About herbs – Bindweed
- https://jeffreydachmd.com/fenofibrate-anti-cancer-drug/